إنه مزدحم جدًا في نخاع العظام. تتعايش أنواع عديدة من الخلايا الجذعية والسلفية جنبًا إلى جنب ، بما في ذلك أسلاف الخلايا المناعية1و2 وتدعمها الخلايا المجاورة التي تولد بيئات حماية متخصصة للخلايا الجذعية تسمى المنافذ. التفاعل بين خلايا الموضع ، المعروف أيضًا باسم الخلايا اللحمية ، والأسلاف المبكرة للخلايا المناعية في نخاع العظم غير مفهوم جيدًا. سيساعدنا التعرف على كيفية تنسيق هذا التفاعل على فهم أفضل لكيفية تكوين أسلاف الخلايا المناعية. الكتابة طبيعة سجيةشين وآخرون.3 حللوا جزءًا من اللغز من خلال تحديد دور للحركة في تحفيز الاتصال بين نوع واحد من الخلايا اللحمية والأسلاف المناعية في الفئران ، مما يساعد الحيوانات في النهاية على مكافحة العدوى.
الأنواع المختلفة من الخلايا الجذعية والسلفية في نخاع العظم مترابطة بشكل كبير ، جسديًا ووظيفيًا. على سبيل المثال ، تعتبر الخلايا الجذعية واللحمية السلفية ، التي تؤدي إلى تكوين العظام والأنسجة الهيكلية والخلايا الدهنية ، جزءًا أساسيًا من مكانة اللحمة للخلايا الجذعية المكونة للدم والخلايا السلفية (HSPCs). HSPCs ، بدورها ، مسؤولة عن إنتاج جميع سلالات خلايا الدم ، بما في ذلك الخلايا المناعية4. في الفئران ، تنتج بعض أسلاف اللحمة المتوسطة بروتين إشارة ، يسمى عامل الخلايا الجذعية (SCF) ، وهو أمر بالغ الأهمية لدعم HSPCs5. تعبر هذه الخلايا أيضًا عن بروتين على سطح الخلية يسمى مستقبل اللبتين5 (LepR). التعبير عن الجذام (LepR+) توجد الخلايا في عدة مواقع متميزة في نخاع العظام ، بما في ذلك حوالي نوعين من الأوعية الدموية ، الشرايين والجيوب الأنفية. ومع ذلك ، فإن LepR+ السكان عبارة عن مزيج من أنواع الخلايا السلفية الوسيطة5شين وآخرون. المنصوص عليها في المنزل في المجموعة الفرعية من LepR+ تشارك في الحفاظ على مكانة HSPC.
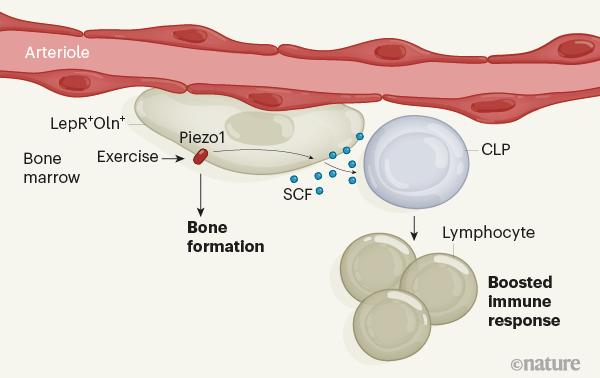
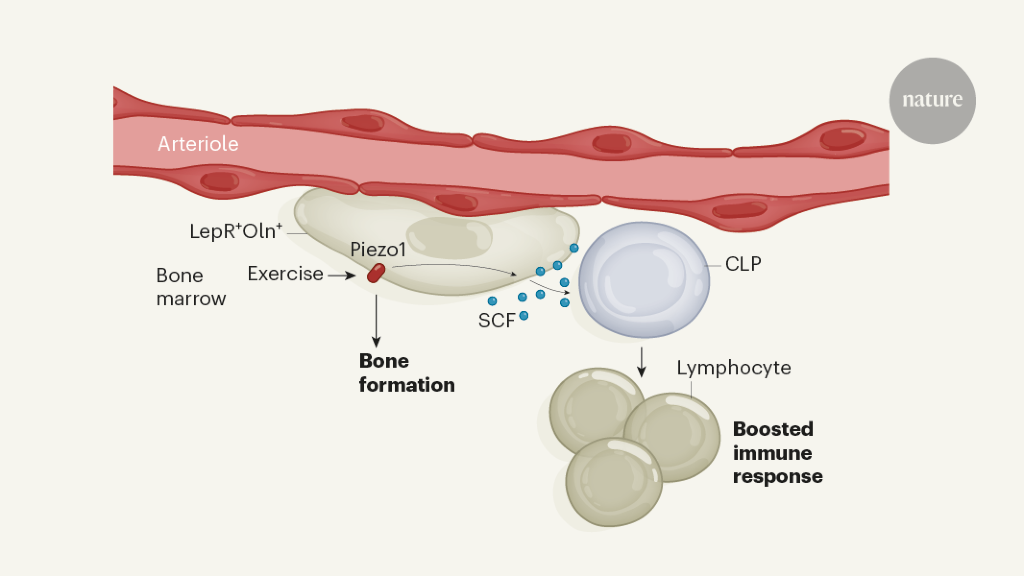
أجرى المؤلفون تحليل التعبير الجيني لـ LepR+ الخلايا ، التي كشفت أن مجموعة سكانية فرعية تعبر أيضًا عن بروتين محدد آخر ، أوستيولكتين (أولن). ولدت المجموعة الفئران التي كان هؤلاء أولن+ تتألق الخلايا ، ووجدت أن أولن+ توجد الخلايا اللحمية حول الشرايين ولكن ليس الجيوب الأنفية. بعد ذلك ، أثبتوا أن الخلايا هي أسلاف عظمية قصيرة العمر ، تؤدي إلى ظهور خلايا مكونة للعظام تسمى بانيات العظم التي لها دور حاسم في تجديد العظام.
ثم قام شين وزملاؤه بهندسة الفئران الطافرة لتفتقر إلى الجين المشفر لـ SCF في Oln+ الخلايا. النقص الناتج من SCF في Oln+ لم تؤثر الخلايا على الخلايا الجذعية المكونة للدم أو معظم الأنواع الأخرى من الخلايا السلفية المكونة للدم في نخاع العظم. ومع ذلك ، فقد أدى ذلك إلى انخفاض كبير في عدد نوع خاص واحد من السلف المكونة للدم – السلف اللمفاوي الشائع (CLP) ، والذي يؤدي إلى ظهور خلايا مناعية تسمى الخلايا الليمفاوية. دعما لفكرة أن Oln+ تساعد الخلايا على إنشاء CLPs والحفاظ عليها ، أوضح المؤلفون أن Oln+ تتواجد الخلايا و CLPs بالقرب من نخاع العظام. قاموا بعد ذلك بإصابة الفئران الطافرة ببكتيريا مسببة للأمراض ، الليسترية المستوحدة، والتي عادة ما يتم تطهيرها من الجسم عن طريق الخلايا الليمفاوية. قامت الحيوانات الطافرة بإزالة العامل الممرض بشكل أقل فاعلية من الضوابط. لم تنتج الحيوانات ببساطة ما يكفي من الخلايا الليمفاوية للقيام بهذه المهمة ، بسبب انخفاض عدد CLPs.
من المعروف أن التحفيز الميكانيكي للعظام ، الذي يحدث أثناء التمرين ، يعزز تكوين العظام6. في مجموعة التجارب النهائية ، شين وآخرون. وضع الفئران في أقفاص بها عجلات متحركة ، ووجدوا أن الجري أدى إلى زيادة عدد كل من Oln+ الخلايا و CLPs في نخاع العظام. وجدت المجموعة أن أولن+ تعبر الخلايا عن بروتين القناة الأيونية الحساس للميكانيكا Piezo1 ، وأظهرت أن أرقام CLP منخفضة بشكل غير طبيعي في الفئران المصممة هندسيًا لتفتقر إلى هذا البروتين. وهكذا ، كشف المؤلفون عن مسار غير معروف سابقًا ، حيث تؤدي التمارين ، التي يتم استشعارها من خلال البروتين الحساس للميكانيكية Piezo1 ، إلى تحفيز تعبير SCF في أسلاف العظام للمساعدة في الحفاظ على CLPs ، وبالتالي التحكم في جزء من وظيفة الجهاز المناعي (الشكل 1).
إن اكتشاف أن أسلاف تكوّن العظم حساسة ميكانيكيًا لها دور في مكافحة الالتهابات البكتيرية أمر مثير. كان من المعروف أن الحركة يمكن أن تحفز جهاز المناعة7، ولكن التقدم في عمل شين وزملائه يقدم أحد الأسباب وراء ذلك. إذا كان العمل مناسبًا للبشر ، فقد يكون للعمل تطبيقات سريرية مباشرة. على سبيل المثال ، يمكن تسخير المسار الذي تم الكشف عنه في الدراسة الحالية لتطوير علاجات أفضل لتقوية إنتاج الخلايا المناعية الناتجة عن الحركة. تتمثل الخطوة المنطقية التالية في اختبار ما إذا كان الجري الطوعي يمكنه بالفعل تحسين إزالة البكتيريا في الفئران. سيكون السؤال الرئيسي الآخر الذي يجب معالجته هو ما إذا كانت زيادة أعداد Oln+ تساعد الخلايا و CLPs في نخاع العظام على توفير الحماية ضد البكتيريا الأخرى المسببة للأمراض ، أو حتى الفيروسات ، أو ما إذا كانت ستعزز أيضًا استجابات التطعيم.
وجد المؤلفون أيضًا أن عدد أولن+ كان عدد المنافذ ، وعدد CLPs ، أقل في نخاع العظام للفئران البالغة من العمر 18 شهرًا مقارنة بنظيراتها البالغة من العمر شهرين. الحيوانات المسنة نشطة أيضًا8، لذلك قد تساهم عوامل أخرى غير انخفاض الحركة في هذا التدهور المرتبط بالشيخوخة.
سيكون من المثير للاهتمام أن نتحرى ، على سبيل المثال ، ما إذا كانت الطريقة التي استخدمها Oln+ تستشعر المنافذ تغيرات التحفيز الميكانيكي بمرور الوقت ، أو ما إذا كانت التغييرات اللاجينية (تعديلات على الحمض النووي يمكن أن تغير التعبير الجيني دون تغيير تسلسل الحمض النووي الأساسي) في سن أولن+ تجعلها الخلايا أقل فعالية في توليد جزيئات الإشارات مثل SCF.
يعد الاستشعار الميكانيكي جيدًا للعب دور في فسيولوجيا العظام ، ولكن تم أيضًا وصف دور حاسم للإشارة الميكانيكية لأنواع الخلايا الأخرى – على سبيل المثال ، خلايا سلف البنكرياس والخلايا الجذعية المعوية والخلايا البطانية التي تبطن الأوعية الدموية. على الرغم من أنه لا يُعرف الكثير عن المنافذ التي تدعم الخلايا الجذعية خارج نخاع العظم ، إلا أن الأوعية الدموية ، وكذلك الخلايا البطانية ، تعتبر مرشحة أساسية لتشكيل مثل هذه المنافذ. من الممكن ، إذن ، أن يساهم الاستشعار الميكانيكي في الخلايا البطانية ذات التكوين المتخصص في الحفاظ على الأنواع الأخرى من الخلايا الجذعية والسلفية. إذا كان الأمر كذلك ، فقد يكون لعمل شين وزملائه آثار واسعة النطاق على بيولوجيا الخلايا الجذعية.

“هواة الإنترنت المتواضعين بشكل يثير الغضب. مثيري الشغب فخور. عاشق الويب. رجل أعمال. محامي الموسيقى الحائز على جوائز.”