

HT-MEK – اختصار لحركية إنزيم موائع جزيئية عالية الإنتاجية – يجمع بين تقنيات الموائع الدقيقة وتقنيات تخليق البروتين الخالي من الخلايا لتسريع دراسة الإنزيمات بشكل كبير. الائتمان: دانيال مختاري
ستتيح الأداة الجديدة التي تمكن آلاف التجارب الصغيرة من العمل في وقت واحد على شريحة بوليمر واحدة للعلماء دراسة الإنزيمات بشكل أسرع وأكثر شمولاً من أي وقت مضى.
بالنسبة للكثير من تاريخ البشرية ، كان يُنظر إلى الحيوانات والنباتات على أنها تتبع مجموعة مختلفة من القواعد عن بقية الكون. في القرنين الثامن عشر والتاسع عشر ، بلغ هذا ذروته في الاعتقاد بأن الكائنات الحية قد تم غرسها بواسطة طاقة غير مادية أو “قوة الحياة” التي سمحت لها بإجراء تحولات ملحوظة لا يمكن تفسيرها بالكيمياء التقليدية أو الفيزياء وحدها.
يدرك العلماء الآن أن هذه التحولات يتم تشغيلها بواسطة الإنزيمات – جزيئات البروتين المكونة من سلاسل من الأحماض الأمينية التي تعمل على تسريع أو تحفيز تحويل نوع واحد من الجزيء (ركائز) إلى (منتجات) أخرى. من خلال القيام بذلك ، فإنها تمكن من تفاعلات مثل الهضم والتخمير – وجميع الأحداث الكيميائية التي تحدث في كل خلية من خلايانا – والتي ، إذا تُركت وحدها ، ستحدث ببطء غير عادي.
قال بولي فورديس ، الأستاذ المساعد في الهندسة الحيوية وعلم الوراثة في جامعة ستانفورد: “يمكن أن يحدث تفاعل كيميائي قد يستغرق وقتًا أطول من عمر الكون بمفرده في ثوانٍ بمساعدة الإنزيمات”.
في حين يُعرف الكثير الآن عن الإنزيمات ، بما في ذلك هياكلها والمجموعات الكيميائية التي تستخدمها لتسهيل التفاعلات ، فإن التفاصيل المحيطة بكيفية ارتباط أشكالها بوظائفها ، وكيف تسحب سحرها الكيميائي الحيوي بهذه السرعة والنوعية غير العادية لا تزال غير جيدة يفهم.
تقنية جديدة ، طورتها فورديس وزملاؤها في جامعة ستانفورد وتم تفصيلها هذا الأسبوع في المجلة علوم، يمكن أن تساعد في تغيير ذلك. يطلق عليها اسم HT-MEK – اختصارًا لحركية إنزيم الموائع الدقيقة عالية الإنتاجية – يمكن لهذه التقنية ضغط سنوات من العمل إلى بضعة أسابيع فقط عن طريق تمكين إجراء آلاف تجارب الإنزيم في وقت واحد. قال دان هيرشلاغ ، القائد المشارك للدراسة ، أستاذ الكيمياء الحيوية في كلية الطب بجامعة ستانفورد: “إن القيود التي تحد من قدرتنا على إجراء تجارب كافية منعتنا من تشريح وفهم الإنزيمات حقًا”.

تُظهر الصورة المقربة لجهاز HT-MEK الغرف الفردية ذات الحجم النانوليتر حيث يتم إجراء تجارب الإنزيم. الائتمان: دانيال مختاري
من خلال السماح للعلماء بالتحقيق بعمق خارج “الموقع النشط” الصغير للإنزيم حيث يحدث ارتباط الركيزة ، يمكن لـ HT-MEK الكشف عن أدلة حول كيفية عمل حتى الأجزاء الأبعد من الإنزيمات معًا لتحقيق تفاعلها الرائع.
قال فورديس: “يبدو الأمر كما لو أننا الآن نأخذ مصباحًا كشافًا وبدلاً من مجرد تسليطه على الموقع النشط ، نقوم بتسليطه على الإنزيم بأكمله”. “عندما فعلنا هذا ، رأينا الكثير من الأشياء التي لم نتوقعها.”
الحيل الأنزيمية
تم تصميم HT-MEK ليحل محل عملية شاقة لتنقية الإنزيمات التي تضمنت تقليديًا بكتيريا هندسية لإنتاج إنزيم معين ، وتنميتها في أكواب كبيرة ، وتفجير الميكروبات ، ثم عزل الإنزيم المعني عن جميع المكونات الخلوية الأخرى غير المرغوب فيها. لتجميع كيفية عمل الإنزيم ، أدخل العلماء أخطاء متعمدة في مخطط الحمض النووي الخاص به ثم تحليل كيفية تأثير هذه الطفرات على التحفيز.
هذه العملية باهظة الثمن وتستغرق وقتًا طويلاً ، ومع ذلك ، مثل الجمهور الذي يركز على يد ساحر أثناء خدعة ساحرة ، حصر الباحثون في الغالب تحقيقاتهم العلمية في المواقع النشطة للإنزيمات. “نحن نعرف الكثير عن جزء الإنزيم حيث تحدث الكيمياء لأن الناس قاموا بإجراء طفرات هناك ليروا ما سيحدث. قال فورديس “لقد استغرق ذلك عقودًا”.
ولكن كما يعلم أي خبير في الحيل السحرية ، فإن مفتاح الوهم الناجح لا يمكن أن يكمن فقط في تصرفات أصابع الساحر ، بل قد يتضمن أيضًا وضع ذراع أو جذع ببراعة ، أو طقطقة مضللة أو أفعال منفصلة تحدث خارج الكواليس ، غير مرئي للجمهور. يسمح HT-MEK للعلماء بتحويل نظرهم بسهولة إلى أجزاء من الإنزيم خارج الموقع النشط واستكشاف كيف ، على سبيل المثال ، تغيير شكل سطح الإنزيم قد يؤثر على عمل الجزء الداخلي منه.
قال فورديس: “نود في النهاية أن نفعل الحيل الأنزيمية بأنفسنا”. “لكن الخطوة الأولى هي معرفة كيفية القيام بذلك قبل أن نتمكن من تعليم أنفسنا القيام بذلك.”
تجارب الإنزيم على شريحة
تم تطوير التكنولوجيا الكامنة وراء HT-MEK وصقلها على مدار ست سنوات من خلال شراكة بين مختبرات Fordyce و Herschlag. قال هيرشلاغ: “هذه حالة رائعة من الهندسة وعلم الإنزيمات يجتمعان معًا – ونأمل – إحداث ثورة في مجال ما”. “تجاوز هذا المشروع تعاونك المعتاد – فقد كان عبارة عن مجموعة من الأشخاص يعملون معًا لحل مشكلة صعبة للغاية – ويستمر في المنهجيات المعمول بها لمحاولة الإجابة على الأسئلة الصعبة.”
يجمع HT-MEK بين تقنيتين موجودتين لتسريع تحليل الإنزيم. الأول هو الموائع الدقيقة ، والذي يتضمن تشكيل شرائح البوليمر لإنشاء قنوات مجهرية للمعالجة الدقيقة للسوائل. قال فورديس: “تقلل الموائع الدقيقة المساحة المادية لإجراء هذه التجارب الموائعة بالطريقة نفسها التي قللت بها الدوائر المتكاملة العقارات اللازمة للحوسبة”. “في علم الإنزيمات ، ما زلنا نقوم بأشياء في هذه القوارير العملاقة بحجم لتر. كل شيء بحجم ضخم ولا يمكننا القيام بأشياء كثيرة في وقت واحد “.
والثاني هو تخليق البروتين الخالي من الخلايا ، وهي تقنية تأخذ فقط تلك القطع الحيوية من الآلات البيولوجية اللازمة لإنتاج البروتين وتجمعها في خلاصة حساء يمكن استخدامها لإنشاء إنزيمات اصطناعية ، دون الحاجة إلى الخلايا الحية للعمل كحاضنات.
أوضح فورديس: “لقد أتمتة ذلك حتى نتمكن من استخدام الطابعات لإيداع البقع المجهرية من ترميز الحمض النووي الاصطناعي للإنزيم الذي نريده على شريحة ثم محاذاة غرف بحجم نانوليتر مليئة بمزيج بادئ البروتين فوق البقع”.
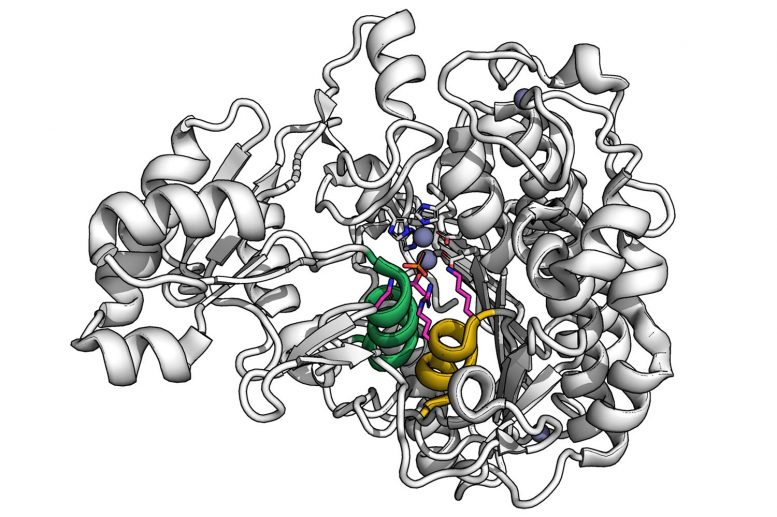
استخدم العلماء HT-MEK لدراسة كيفية تأثير الطفرات في أجزاء مختلفة من إنزيم مدروس جيدًا يسمى PafA على قدرته التحفيزية. الائتمان: دانيال مختاري
نظرًا لأن كل حجرة صغيرة تحتوي فقط على جزء من الألف من المليون من لتر من المواد ، يمكن للعلماء هندسة آلاف المتغيرات من الإنزيم في جهاز واحد ودراستها بالتوازي. عن طريق تعديل تعليمات الحمض النووي في كل غرفة ، يمكنهم تعديل سلاسل جزيئات الأحماض الأمينية التي يتكون منها الإنزيم. بهذه الطريقة ، من الممكن أن تدرس بشكل منهجي كيف تؤثر التعديلات المختلفة على الإنزيم على طيه وقدرته التحفيزية وقدرته على ربط الجزيئات الصغيرة والبروتينات الأخرى.
عندما طبق الفريق أسلوبهم على إنزيم مدروس جيدًا يسمى PafA ، وجدوا أن الطفرات التي تتجاوز الموقع النشط تؤثر على قدرته على تحفيز التفاعلات الكيميائية – في الواقع ، فإن معظم الأحماض الأمينية ، أو “البقايا” ، التي يتكون منها الإنزيم تأثيرات.
اكتشف العلماء أيضًا أن عددًا مفاجئًا من الطفرات تسبب في اختلال PafA في حالة بديلة غير قادرة على إجراء التحفيز. قال المؤلف المشارك الأول للدراسة كريج ماركين Craig Markin ، وهو عالم أبحاث له مواعيد مشتركة في معمل فورديس وهيرشلاغ.
وأكد هيرشلاغ أن “هذا إنزيم واحد من بين آلاف وآلاف”. “نتوقع أن يكون هناك المزيد من الاكتشافات والمزيد من المفاجآت.”
التعجيل التقدم
إذا تم اعتماده على نطاق واسع ، فلن يتمكن HT-MEK من تحسين فهمنا الأساسي لوظيفة الإنزيم فحسب ، بل يمكنه أيضًا تحفيز التقدم في الطب والصناعة ، كما يقول الباحثون. “الكثير من المواد الكيميائية الصناعية التي نستخدمها الآن ضارة بالبيئة وليست مستدامة. قال المؤلف الأول المشارك في الدراسة دانييل مختاري ، وهو طالب دراسات عليا في ستانفورد في مختبري هيرشلاغ وفوردايس ، إن الإنزيمات تعمل بشكل أكثر فاعلية في أكثر المواد حميدة بيئيًا لدينا – الماء.
يمكن لـ HT-MEK أيضًا تسريع نهج لتطوير الأدوية يسمى الاستهداف الخيفي ، والذي يهدف إلى زيادة خصوصية الدواء من خلال الاستهداف خارج الموقع النشط للإنزيم. تعتبر الإنزيمات أهدافًا دوائية شائعة بسبب الدور الرئيسي الذي تلعبه في العمليات البيولوجية. لكن البعض يعتبر “غير قابل للتخلص” لأنهم ينتمون إلى عائلات من الإنزيمات ذات الصلة التي تشترك في نفس المواقع النشطة أو متشابهة جدًا ، ويمكن أن يؤدي استهدافها إلى آثار جانبية. تكمن الفكرة وراء الاستهداف الخيفي في إنشاء عقاقير يمكنها الارتباط بأجزاء من الإنزيمات التي تميل إلى أن تكون أكثر تمايزًا ، مثل أسطحها ، ولكنها لا تزال تتحكم في جوانب معينة من التحفيز. قال ماركين: “مع PafA ، رأينا اتصالًا وظيفيًا بين السطح والموقع النشط ، وهذا يمنحنا الأمل في أن الإنزيمات الأخرى سيكون لها أهداف مماثلة”. “إذا تمكنا من تحديد مكان الأهداف الخيفية ، فسنكون قادرين على البدء في المهمة الأصعب المتمثلة في تصميم الأدوية لها بالفعل.”
سيكون الكم الهائل من البيانات التي يُتوقع أن ينتجها HT-MEK أيضًا نعمة للنُهج الحسابية وخوارزميات التعلم الآلي ، مثل مشروع AlphaFold الممول من Google ، المصمم لاستنتاج شكل إنزيم ثلاثي الأبعاد معقد من تسلسل الأحماض الأمينية وحده. قال مختاري: “إذا كان للتعلم الآلي أي فرصة للتنبؤ بدقة بوظيفة الإنزيم ، فسوف يحتاج إلى نوع البيانات التي يمكن أن يوفرها HT-MEK للتدريب عليها”.
أبعد من ذلك بكثير ، قد يسمح HT-MEK للعلماء بعكس هندسة الإنزيمات وتصميم أصناف خاصة بهم. قال فورديس: “البلاستيك مثال رائع”. “نود إنتاج إنزيمات يمكنها تحويل المواد البلاستيكية إلى قطع غير سامة وغير ضارة. إذا كان صحيحًا حقًا أن الجزء الوحيد المهم من الإنزيم هو موقعه النشط ، فسنكون قادرين على القيام بذلك وأكثر بالفعل. لقد حاول العديد من الأشخاص وفشلوا ، ويُعتقد أن أحد أسباب عدم قدرتنا ذلك هو أن باقي الإنزيم مهم للحصول على الموقع النشط بالشكل الصحيح تمامًا وللتذبذب بالطريقة الصحيحة “.
يأمل هيرشلاغ أن يكون تبني HT-MEK بين العلماء سريعًا. “إذا كنت متخصصًا في الإنزيمات تحاول التعرف على إنزيم جديد ولديك الفرصة للنظر في 5 أو 10 طفرات خلال ستة أشهر أو 100 أو 1000 طفرة من إنزيمك خلال نفس الفترة ، فماذا ستختار؟” هو قال. “هذه أداة لديها القدرة على استبدال الأساليب التقليدية لمجتمع بأكمله.”
المرجع: “الكشف عن الهندسة الوظيفية للإنزيم من خلال حركيات إنزيم الموائع الدقيقة عالية الإنتاجية” بقلم CJ Markin و DA Mokhtari و F. Sunden و MJ Appel و E. Akiva و SA Longwell و C. Sabatti و D. Herschlag و PM Fordyce ، 23 يوليو 2021 و علوم.
DOI: 10.1126 / science.abf8761
فورديس عضو في ستانفورد بيو إكس ومعهد وو تساي للعلوم العصبية ، وعضو اللجنة التنفيذية في ستانفورد تشيم-إتش. هيرشلاغ عضو في Bio-X ومعهد ستانفورد للسرطان ، وزميل كلية ChEM-H. ومن بين المؤلفين المشاركين الآخرين في جامعة ستانفورد ، فاني سوندن ، وماسون أبيل ، وإيال أكيفا ، وسكوت لونجويل ، وكيارا ساباتي.
تم تمويل البحث من قبل Stanford Bio-X ، و Stanford ChEM-H ، وبرنامج ستانفورد لتدريب العلماء الطبيين ، والمعاهد الوطنية للصحة ، والمبادرة المشتركة للقياس في علم الأحياء ، ومؤسسة Gordon and Betty Moore ، ومؤسسة Alfred P. Sloan ، The Chan Zuckerberg Biohub والمعاهد الكندية للأبحاث الصحية.

“هواة الإنترنت المتواضعين بشكل يثير الغضب. مثيري الشغب فخور. عاشق الويب. رجل أعمال. محامي الموسيقى الحائز على جوائز.”
